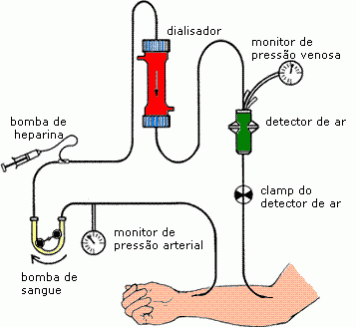
Já vimos o que é e em que consiste o processo de hemodiálise, mas qual é a importância do tratamento e purificação da água neste tipo de tratamento??
A verdade é que, senão for usada um água limpa e livre de impurezas, o processo de hemodiálise seria inútil e provavelmente prejudicial. As clínicas que hoje em dia fornecem serviços de hemodiálise são responsáveis pelo tratamento da água que usam.
Mas que processos de purificação existem e em que consistem?
Relativamente à hemodiálise, os processos mais usados são os processo de desionização e osmose inversa, por vezes usados em simultaneo para maximizar o rendimento e eficiência.
– Desionização da Água (Permuta iónica)
A desionização (também chamada permuta iónica) é muito usada em laboratórios para fornecer água purificada conforme necessária. Os desionizadores de laboratório incorporam invariavelmente cartuchos de leitos mistos de resinas de permuta iónica que ou são devolvidos a uma estação de regeneração para recarregar quando ficam exaustos ou então são descartados. Aniões e catiões presentes na água de alimentação são removidos pelas resinas de permuta iónica e substituídos por iões de hidrogénio e hidróxilo da resina. Os iões de hidrogénio e de hidróxilo combinam-se para formar moléculas de água.
Como funciona a permuta iónica?
A permuta iónica troca iões de hidrogénio por contaminantes catiónicos e iões de hidróxilo (OH-) por contaminantes aniónicos presentes na água de alimentação. Os leitos de resinas de permuta iónica são constituídos por pequenos grânulos esféricos através dos quais passa a água de alimentação. Ao fim de algum tempo, os catiões e aniões terão substituído a maior parte dos pontos de hidrogénio e hidróxilo activos nas resinas e os cartuchos necessitarão de ser substituídos ou regenerados.
Quais são as vantagens/desvantagens da permuta iónica?
A permuta iónica tem muitas vantagens relativamente à destilação no que respeita à produção de água purificada. Em primeiro lugar, é um processo de resposta a pedido; a água fica disponível quando é necessária. Em segundo lugar, quando se usam materiais de resina de elevada pureza, efectivamente, todo o material iónico é removido da água para dar uma resistividade máxima de 18,2 MΩ-cm (a 25ºC). Pequenos fragmentos dos materiais de resina de permuta iónica podem ser expelidos do cartucho pela água que passa através do mesmo. A permuta iónica deve, portanto, ser usada juntamente com filtros se se desejar uma água isenta de partículas. Dado que as bactérias se desenvolvem rapidamente em água parada, os cartuchos podem ficar contaminados se não forem regularmente usados. O problema é atenuado pela recirculação frequente da água para inibir o desenvolvimento de bactérias e pela substituição ou regeneração regular das resinas, dado que os químicos regenerantes são desinfectantes poderosos. A permuta iónica remove apenas compostos orgânicos polares da água e os orgânicos dissolvidos podem sujar os grânulos de permuta iónica, reduzindo a sua capacidade. Quando é necessária água pura em termos orgânicos e inorgânicos, a combinação de osmose inversa seguida de permuta iónica é especialmente efectiva. Têm havido muitas tentativas de ultrapassar algumas das limitações da permuta iónica e da destilação. Nalguns sistemas, a destilação precede a permuta iónica – os cartuchos duram muito mais, mas o problema das bactérias mantém-se. Noutros, a permuta iónica precede a destilação – mas nesse caso mantêm-se os problemas de armazenamento e de não ter água a pedido.
– Osmose Reversa
A osmose reversa (ou inversa) é um processo que resolve muitos dos problemas da destilação e da desionização. É o processo reverso da osmose celular, e é usado para dessalinizar soluções aquosas. Usando membranas de alta performance, e possível hoje remover mais de 99% de todos os sais de uma solução. Consiste num processo de separação em que um solvente é separado de um soluto de baixa massa molecular por uma membrana permeável ao solvente e impermeável ao soluto. Em osmose inversa, as membranas retêm partículas cujo diâmetro varia entre 1 e 10 Å(2). As partículas retidas são solutos de baixa massa molecular como sais ou moléculas orgânicas simples. Por este motivo, a osmose é aplicada a processos como a dessanilização da água do mar ou a recuperação de águas residuais na indústria. Como as partículas são muito pequenas, a pressão osmótica das soluções é elevada. Para que a velocidade de permeado seja razoável, a diferença de pressão hidrostática através da membrana tem que ser elevada, atingindo valores entre 3 e 100 atm(2), dependendo do tipo de aplicação. A osmose reversa é uma tecnologia que oferece uma alta relação custo/benefício em sistemas de purificação de água; ela é geralmente usada juntamente com cartuchos de resinas trocadoras de iões (permuta iónica) de modo a maximizar a vida dos mesmos e a prover uma água com baixo teor de iões. A água dispensada directamente da osmose reversa possui um nível baixo de bactérias e pirogénios.
Fontes
http://elquifis.blogspot.com/2007/12/o-que-desionizao-da-gua.html
http://www.micronal.com.br/artigostecnicos/analise_agua_tratamento_especial.htm